尽管使用全基因组关联研究已经鉴定出90多个独立的帕金森病(PD)风险变异位点,但大多数研究仅在单一人群中进行。本研究进行了一项大规模的多种族PDmeta分析,包括49,049例病例、18,785个代理病例和2,458,063个对照个体,涵盖了欧洲、东亚、拉丁美洲和非洲祖先的个体。在meta分析中,该研究鉴定了78个独立的全基因组显著位点,包括12个潜在的新位点(MTF2、PIK3CA、ADD1、SYBU、IRS2、USP8、PIGL、FASN、MYLK2、USP25、EP300和PPP6R2),并在6个已知PD位点上精细定位了6个假定的因果变异。通过结合该研究的结果与公开可用的eQTL数据,该研究在这12个新位点中识别了25个假定的风险基因,这些基因的表达与PD风险相关联。
一,背景
帕金森病(Parkinson's disease, PD)是一种以多巴胺神经元丢失和路易体(Lewy bodies)在大脑中的形成为特征的神经退行性疾病。PD遗传风险因素的识别对于减轻疾病的全球负担至关重要。虽然之前在欧洲人群中进行的大型PD全基因组关联研究(GWAS)已经揭示了90个独立的遗传风险变异,但大多数研究仅在单一人群中进行。在东亚和拉丁美洲人群中进行的类似大规模PD GWAS研究也各自发现了两个在欧洲人群中未被鉴定的风险位点。对于PD而言,这些研究强调了在不同种族群体中进行遗传研究的重要性,以揭示可能的种族特异性风险因素,并推动精准医疗的发展。
二,方法
1,研究设计和队列描述
本研究采用了单一联合meta分析的研究设计,目的是通过整合不同祖先群体的数据来最大化统计power。数据集涵盖了欧洲、东亚、拉丁美洲和非洲的个体,包括了49,049例帕金森病(PD)患者、18,618例PD代理病例和2,458,063名神经学上健康的对照个体。研究使用了先前针对欧洲、东亚和拉丁美洲人群的全基因组关联研究(GWAS)结果,同时,非洲人群的数据以及额外的拉丁美洲和东亚人群的GWAS汇总统计数据由23andMe公司提供。芬兰人群的GWAS汇总数据来自FinnGen,且研究特别选择了FinnGen项目中排除了有精神疾病或神经系统疾病的对照组的帕金森病数据。
2,23andMe多祖源数据
23andMe公司提供的PD病例和对照组数据来自于自我报告的参与者,他们在线上参与了研究,并在外部AAHRPP认证的机构审查委员会的批准下提供了知情同意。样本经过了多种Illumina基因分型平台的基因分型,并通过Finch或Eagle2软件进行了分相,随后使用Minimac3软件和1000 Genomes Phase III及UK10K数据进行了插补。样本经过了基于基因型的分类,以区分非洲人、东亚人或拉丁人,并确保只包括不相关的个体。在分析中,研究调整了年龄、性别、前五个主成分和基因分型平台的影响。
3,meta分析
研究使用MR-MEGA软件和PLINK软件对GWAS结果进行了meta分析。MR-MEGA软件通过生成每个队列的遗传变异轴来进行meta回归分析,这些轴随后作为分析中的协变量,以解释不同人群结构的差异。PLINK软件则用于执行随机效应模型分析,以检测等位基因频率的同质性效应。在分析前,所有数据集都经过了协调,映射到了hg19基因组构建上。研究对所有变体进行了筛选,只保留了常染色体上的变体,并对满足条件的变体进行了Bonferroni校正。
4,精细定位(Fine-mapping)
精细定位分析使用MR-MEGA软件进行,该软件可以为每个SNP提供贝叶斯因子的自然对数,帮助识别可能的因果变异。研究选择了在GWAS-meta分析中显著的SNPs,并计算了它们成为因果变异的后验概率。
5,功能注释和基因集富集分析
研究使用FUMA软件对发现结果进行了功能注释,并利用MAGMA软件分析了基因本体论术语和GTEx项目中的组织特异性基因表达数据,以探索与PD相关的生物学途径。同时研究还进行了基因集分析,以识别与PD风险相关的显著基因集。
三,结果
1,meta分析结果
在各个种族群体内,通过连锁不平衡(LD)得分回归得出的遗传协方差截距接近零或接近95%置信区间,这意味着队列之间没有样本重叠。数据协调并映射到基因组构建hg19后,使用随机效应模型和多种族遗传关联的meta回归分析(MR-MEGA)进行了多种族meta分析。随机效应模型对检测不同祖先群体中的同质等位效应具有更大的统计效能。MR-MEGA使用遗传变异轴作为协变量在其meta回归分析中,对检测不同队列中的异质效应具有更大的统计效能。MR-MEGA还使用来自不同队列的等位基因频率产生的遗传变异轴来区分祖先异质性(由于祖先水平遗传变异导致的效果估计差异)和残余异质性。 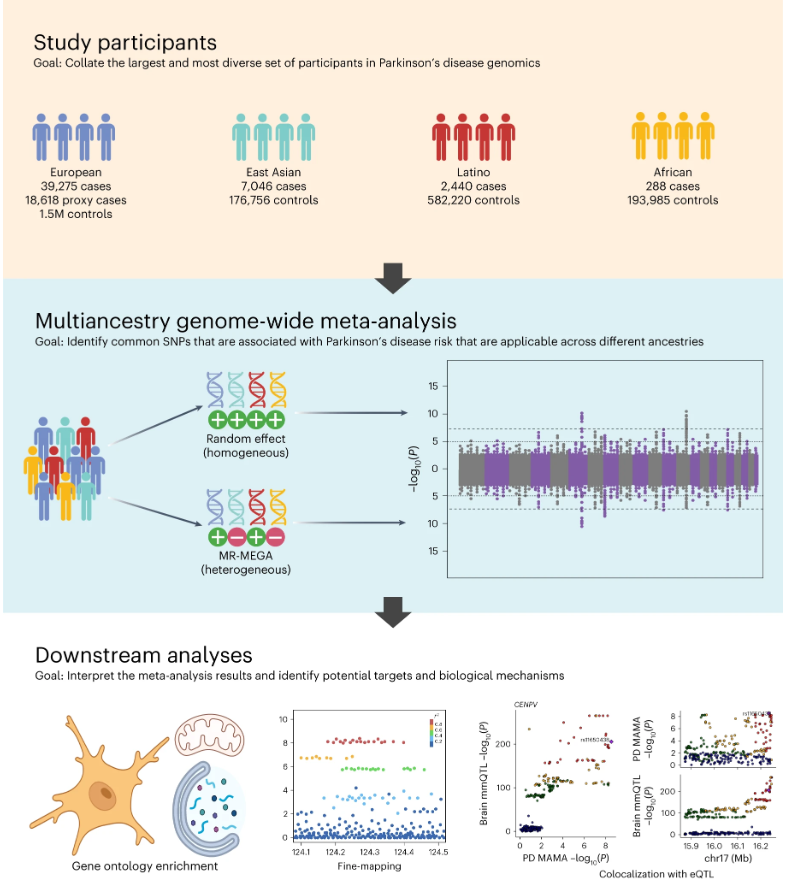 结合随机效应模型和MR-MEGA的结果,研究发现了12个新的PD风险位点和66个来自单祖先GWAS的已知风险位点的命中,这些位点满足了Bonferroni校正后的5×10^-9,这是一个更严格的阈值,用于适应由祖先多样性数据集产生的更多单倍型。在鉴定的78个风险位点中,69个在随机效应模型中显著,3个仅在MR-MEGA中显著。随机效应方法发现的8个新位点在四个不同的祖先群体中显示出同质效应。
结合随机效应模型和MR-MEGA的结果,研究发现了12个新的PD风险位点和66个来自单祖先GWAS的已知风险位点的命中,这些位点满足了Bonferroni校正后的5×10^-9,这是一个更严格的阈值,用于适应由祖先多样性数据集产生的更多单倍型。在鉴定的78个风险位点中,69个在随机效应模型中显著,3个仅在MR-MEGA中显著。随机效应方法发现的8个新位点在四个不同的祖先群体中显示出同质效应。
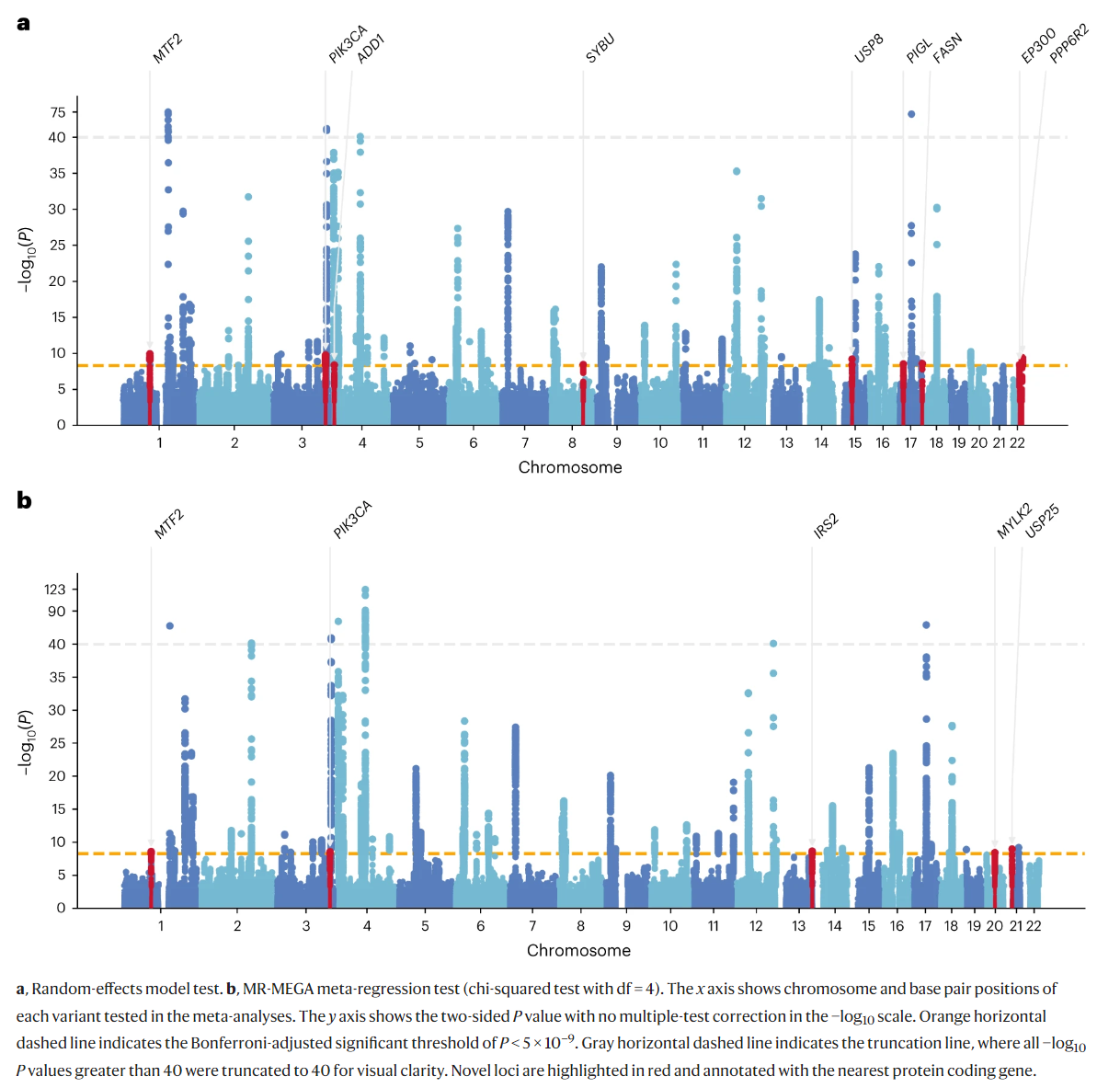
另外通过随机效应方法鉴定的一个新位点(FASN)在所有可用的人群中显示出同质效应,但这个变异在两个东亚数据集中都未通过质量控制。其他三个位点仅在MR-MEGA中显示出祖先异质性效应(IRS2、MYLK2和USP25),但没有显著的残余异质性(PRES-HET > 0.148)支持这些信号是由人群结构差异而非其他混杂因素引起的观点。
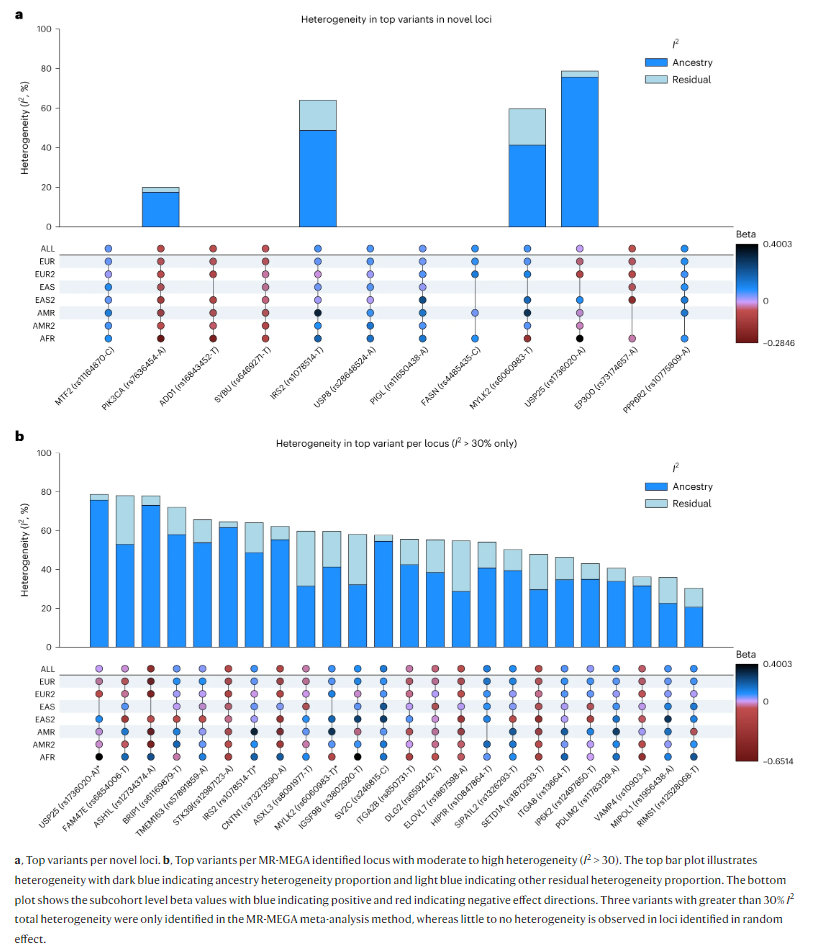
对于IRS2,芬兰队列具有与meta分析效果估计相反的效果方向。同样,MYLK2位点具有与meta分析效果估计差异最大的非洲人群因果效应估计,表明不同人群之间的效应存在异质性。尽管这是一个新的单性状GWAS位点,但其主要SNP之前在精神分裂症和PD之间的多性状条件/联合假发现率(FDR)研究中被鉴定为潜在的多效性位点。最后,USP25位点具有最显著的种族异质性,其效应特定于欧洲和非洲队列,但方向不同。
在观察每个新lead SNP最接近的蛋白质编码基因及其功能丧失不耐受(pLI)评分的概率时,研究发现12个基因中有7个的pLI评分为0.99或1。在具有(MYLK2)和没有(SYBU、PIGL和PPP6R2)显著祖先异质性的位点中发现了pLI评分低的基因。
PESCA v0.3被用于主要的欧洲和东亚人群的meta分析。PESCA利用与种族匹配的连锁不平衡(LD)估计来推断因果变异是特定于特定人群的还是两个人群之间共享,在人群中被识别为共享的变异更有可能是因果的。此外,即使在单祖先研究中尚未被鉴定,该研究也期望在多种族meta分析鉴定的位点中,共享的因果变异具有更高的后验概率(PP)。例如,RIMS1位点的lead SNP(rs12528068)具有很高的作为共享因果变异的PP(PP = 0.972),尽管它在欧洲人群研究中显著,但在东亚人群研究中不显著。该研究还观察到,MTF2、PIK3CA、EP300和PPP6R2在两个人群中作为共享因果变异的PP(PPshared = 0.757, 0.214, 0.769, 0.946)高于作为单一人群的PP(PPEUR<0.080, PPEAS <0.001)。需要注意的是,欧洲和东亚数据之间的样本量差异影响了检测这些位点中特定于人群的因果变异的power。
研究共发现17个提示性的位点,这些位点没有达到我们严格的显著性阈值,但在固定效应meta分析中P值小于5 × 10^−8,在随机效应meta分析中P值小于1 × 10^−6,这17个中有14个是新发现的位点。在23andMe公司的拉丁美洲和非洲队列中,研究特别发现了两个位点靠近JAK1和HS1BP3基因。这些位点的lead SNPs(rs578139575和rs73919910)是非编码的,在欧洲人群中非常罕见,但在非洲人和拉丁美洲人中更为常见。这些位点值得在非洲和拉丁美洲人群中进行进一步研究。
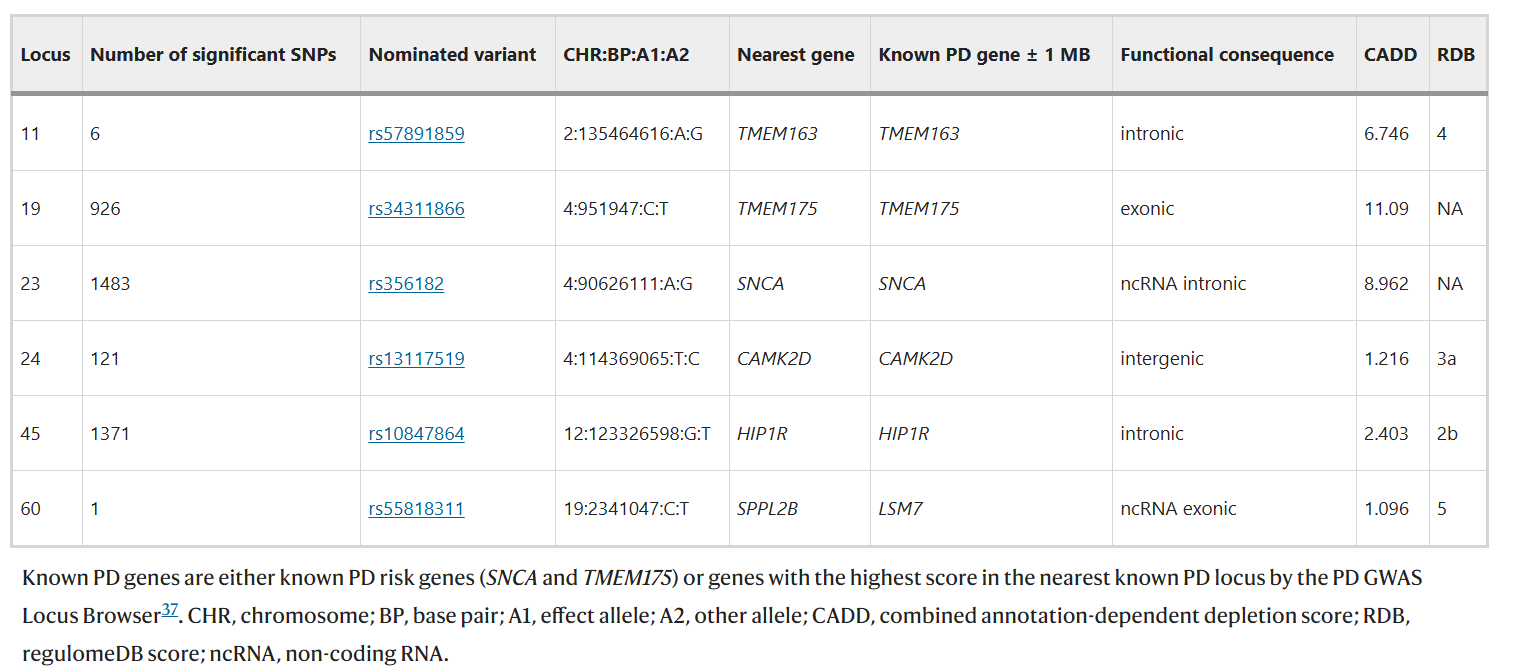
2,精细映射识别结果
研究使用MR-MEGA进行了精细映射,通过种族异质性来提高精细映射分辨率。研究共确定了 23 个基因座,这些基因座在 95% 的可信度集中的变异少于 5 个。其中,MR-MEGA在6个位点中发现了一个PP>95%的单一致病变异:TMEM163、TMEM175、SNCA、CAMK2D、HIP1R和LSM7(见下表)。本研究的结果证实了先前的发现,即TMEM175 p.M393T编码变异是可能的因果变异 。其中HIP1R 中的 rs10847864 位于在黑质组织以及脊髓和大脑中的星形胶质细胞中活跃的转录起始位点。在包含单个变异的可信集合之外,研究还在两个基因中发现了错义变异:FCGR2A(p.H167R,PP = 0.145)和SLC18B1(p.S30P,PP = 0.780)。
3,富集分析析
研究使用FUMA软件对随机效应的结果进行功能注释。研究首先创建了一个自定义的千人基因组参考面板,该面板反映了数据集的种族比例,并运行了多标记基因组注释分析(MAGMA)来分析基因本体论、组织层面和单细胞表达数据。研究在MSigDB v7.0中测试了16,992个基因本体论集,并采用条件分析来排除冗余术语或识别需要一起解释的基因集。研究发现有40个基因集通过条件分析得到了显著富集,其中13个基因集至少与另一个基因集共享信号。在经过多次测试校正后,先前研究中发现显著的两个基因本体论术语在多种族结果中也显著:“策划基因集:Ikeda MIR30目标上调”(PFDR = 0.018)和“细胞组分:液泡膜”(PFDR = 0.047)。此外,在免疫系统途径(小胶质细胞增殖、巨噬细胞增殖、自然杀伤T细胞分化:PFDR < 0.04)、线粒体(对线粒体去极化的响应:PFDR = 0.028)、囊泡(囊泡脱壳、噬菌体溶酶体组装、自噬体成熟调控:PFDR < 0.03)和tau蛋白(tau蛋白激酶活性:PFDR = 0.034)的本体论术语也显著。在组织层面,感兴趣的基因在所有大脑细胞类型以及垂体组织中富集,这与先前的研究结果一致。
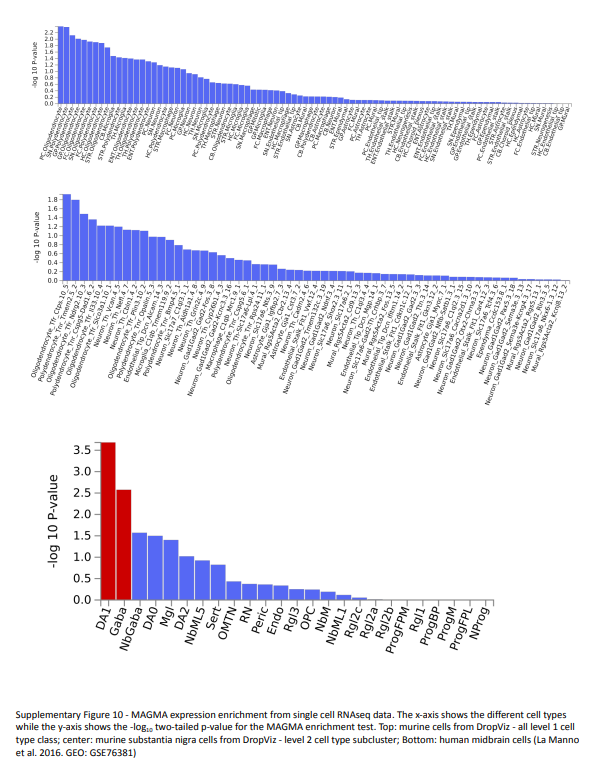
4,eQTL和SMR分析
研究还搜索了GTEx v8版的脑组织表达量性状基因座(eQTLs)和多种族脑eQTL meta分析,以将新发现的位点与基因表达数据相关联。为了将潜在的假定基因与PD风险相关联,研究人员查找了在欧洲人群数据中已完成的基于汇总数据的SMR结果中显著的eQTL基因以及位点附近的基因。将新位点中的SNPs与多种族脑eQTLs进行比较时,发现28个基因显著相关。SMR在四个新位点中发现了与PD风险相关的25个基因。有趣的是,PPP6R2和CENPV在黑质的表达变化与PD风险相关。PPP6R2编码蛋白磷酸酶6调节亚基2,这是蛋白磷酸酶6催化亚基(PPP6C)的调节蛋白,参与囊泡介导的运输途径。中心粒蛋白V(CENPV)参与中心粒形成和细胞分裂过程。
四,讨论
该研究通过大规模的帕金森病GWAS meta分析,整合了多种族的祖先群体,鉴定了66个已知的独立风险位点和12个潜在的新风险位点。研究结果显示,这些新位点中的九个在不同队列中显示出同质效应,而三个则显示出异质效应。此外,通过固定效应和随机效应meta分析的阈值,研究还发现了17个额外的提示性位点。通过利用不同种族群体的遗传多样性进行精细定位,突出了与帕金森病风险相关的组织和细胞类型,这些发现与以往的研究结果一致。最后,通过SMR分析,研究发现了25个可能与新位点附近的帕金森病风险相关的基因。这些新位点包含在先前涉及帕金森病的通路中的基因,例如MTF2和PPP6R2位点中的TMED5和PPP6R2基因,这些基因与内质网到高尔基体的前向运输有关,这在帕金森病的发病机制中是已知的。eQTL和SMR分析显示,PPP6R2和CENPV在黑质中的表达变化与帕金森病风险相关。鉴于黑质退化是帕金森病的一个标志性病理特征,因此PPP6R2和CENPV值得进一步研究。研究还发现了位于已知位点RILPL2中的一个新的独立信号。此外,JAK1和HS1BP3基因位于仅在拉丁美洲和非洲人群中发现的两个提示性位点中,这些基因与细胞因子和炎症信号传导有关,如果这些位点得到确认,将进一步支持炎症在帕金森病中的作用。所有这些潜在的新帕金森病位点都需要额外的复制和功能验证,以阐明它们在帕金森病发病机制中的作用。
参考文献:
[1] Kim JJ, Vitale D, Otani DV, Lian MM, Heilbron K; 23andMe Research Team; Iwaki H, Lake J, Solsberg CW, Leonard H, Makarious MB, Tan EK, Singleton AB, Bandres-Ciga S, Noyce AJ; Global Parkinson’s Genetics Program (GP2); Blauwendraat C, Nalls MA, Foo JN, Mata I. Multi-ancestry genome-wide association meta-analysis of Parkinson's disease. Nat Genet. 2024 Jan;56(1):27-36.




